por: Ladji Méité,1 Marcellin Fotsing,2 e Benoit Barbeau2
Introdução
Embora a cloração tenha demonstrado levar à formação de subprodutos de desinfecção clorados já em 1974 (Rook 1974), esse processo ainda é o mais utilizado como desinfetante de água potável. Baixo custo, disponibilidade, eficácia de desinfecção, provisão de uma concentração residual para desinfecção secundária em sistemas de distribuição e uso histórico estão entre as principais razões para explicar essa situação. As concessionárias de água que optam por usar cloro como parte de seu processo de tratamento de água devem gerenciar a formação de subprodutos de desinfecção clorados (DBPs). Esse objetivo é normalmente verificado pelo monitoramento regulatório de DBPs clorados no sistema de distribuição.
Os trihalometanos (THM) e os ácidos acéticos halogenados (HAA) são os dois grupos de DBPs clorados mais frequentemente regulamentados por várias legislações internacionais. Em Quebec, as concentrações de THM4 e HAA5 na água potável devem ser, respectivamente, inferiores a 80 e 60 µg/L. As concentrações são calculadas como médias anuais usando de uma a oito amostras trimestrais (dependendo do tamanho da população) coletadas nos períodos de residência mais longos (THM) ou médios (HAA) (Gazette Officielle du Quebec 2010). Esses requisitos são mais rigorosos do que as diretrizes da Health Canada, que recomendam concentrações máximas de THM4 e HAA5 de 100 e 80 µg/L (também devem ser gerenciadas como médias anuais em execução).
A ozonização é um poderoso oxidante reconhecido por sua ação desinfetante e oxidante no tratamento de água. É usado principalmente para desinfecção, remoção de ferro e manganês, melhoria de sabores e odores e controle de micro poluentes orgânicos (Reckhow 1999). A produção de água potável micro biologicamente segura, especialmente para o controle de microrganismos resistentes, como o Cryptosporidium, também tem sido um dos principais impulsionadores para a implementação do ozônio (Ran et al. 2010; Talbot et al. 2012). Este processo é comumente implementado em instalações de água potável de Quebec, com um primeiro uso já em 1956 (Ste-Thérèse, QC). Ao longo da última década, o maior rigor da regulamentação de subprodutos de desinfecção levou à sua implementação em muitas estações de tratamento de águas superficiais.
No entanto, estudos anteriores sugerem cautela no uso de ozônio para mitigar DBPs clorados, pois o desempenho do ozônio é altamente dependente das características da água e das condições de ozonização (Doré 1989; Miltner et al. 2008; Song et al. 1999; Staehlin e Hoigné 1985). De fato, o ozônio reage preferencialmente com a fração húmica (hidrofóbica) de NOM e leva a um aumento de sua fração hidrofílica (Galapate et al. 2001; ´Swietlik et al. 2004). A redução do potencial de formação de THM (THMFP) variou de 24 a 46% e foi primeiramente atribuída à transformação de NOM hidrofóbico em hidrofílico e à diminuição da reatividade de ambas as frações após a ozonização (Galapate et al. 2001). Verificou-se que as ligações duplas C=C aromáticas diminuem após a ozonização quando os outros grupos funcionais C-H, C-O e O-H ainda estão presentes na água. A oxidação de grupos aromáticos permite a redução de THM-UFC.
Neste contexto, investigamos o impacto da ozonização na redução de subprodutos da cloração em estações de tratamento de água potável (ETAs) na província de Quebec usando um processo de ozonização como parte de sua estratégia de tratamento. Os principais objetivos deste projeto foram (i) caracterizar a oxidação de precursores de DBPs em ETAs de Quebec usando ozônio e (ii) relacionar o desempenho do ozônio às características de NOM e condições de ozonização. Para atingir esses objetivos, foram realizadas campanhas de amostragem em quinze ETAs localizadas em toda a província de Quebec (Canadá). As amostras foram coletadas antes e após a ozonização em escala real e cloradas em laboratório para a realização das medidas de DBPs sob testes UFC. Uma ozonização em escala laboratorial também foi realizada em cada amostra para padronizar as condições de ozonização de todas as águas investigadas.
Introdução
Embora a cloração tenha demonstrado levar à formação de subprodutos de desinfecção clorados já em 1974 (Rook 1974), esse processo ainda é o mais utilizado como desinfetante de água potável. Baixo custo, disponibilidade, eficácia de desinfecção, provisão de uma concentração residual para desinfecção secundária em sistemas de distribuição e uso histórico estão entre as principais razões para explicar essa situação. As concessionárias de água que optam por usar cloro como parte de seu processo de tratamento de água devem gerenciar a formação de subprodutos de desinfecção clorados (DBPs). Esse objetivo é normalmente verificado pelo monitoramento regulatório de DBPs clorados no sistema de distribuição.
Os trihalometanos (THM) e os ácidos acéticos halogenados (HAA) são os dois grupos de DBPs clorados mais frequentemente regulamentados por várias legislações internacionais. Em Quebec, as concentrações de THM4 e HAA5 na água potável devem ser, respectivamente, inferiores a 80 e 60 µg/L. As concentrações são calculadas como médias anuais usando de uma a oito amostras trimestrais (dependendo do tamanho da população) coletadas nos períodos de residência mais longos (THM) ou médios (HAA) (Gazette Officielle du Quebec 2010). Esses requisitos são mais rigorosos do que as diretrizes da Health Canada, que recomendam concentrações máximas de THM4 e HAA5 de 100 e 80 µg/L (também devem ser gerenciadas como médias anuais em execução).
A ozonização é um poderoso oxidante reconhecido por sua ação desinfetante e oxidante no tratamento de água. É usado principalmente para desinfecção, remoção de ferro e manganês, melhoria de sabores e odores e controle de micro poluentes orgânicos (Reckhow 1999). A produção de água potável micro biologicamente segura, especialmente para o controle de microrganismos resistentes, como o Cryptosporidium, também tem sido um dos principais impulsionadores para a implementação do ozônio (Ran et al. 2010; Talbot et al. 2012). Este processo é comumente implementado em instalações de água potável de Quebec, com um primeiro uso já em 1956 (Ste-Thérèse, QC). Ao longo da última década, o maior rigor da regulamentação de subprodutos de desinfecção levou à sua implementação em muitas estações de tratamento de águas superficiais.
No entanto, estudos anteriores sugerem cautela no uso de ozônio para mitigar DBPs clorados, pois o desempenho do ozônio é altamente dependente das características da água e das condições de ozonização (Doré 1989; Miltner et al. 2008; Song et al. 1999; Staehlin e Hoigné 1985). De fato, o ozônio reage preferencialmente com a fração húmica (hidrofóbica) de NOM e leva a um aumento de sua fração hidrofílica (Galapate et al. 2001; ´Swietlik et al. 2004). A redução do potencial de formação de THM (THMFP) variou de 24 a 46% e foi primeiramente atribuída à transformação de NOM hidrofóbico em hidrofílico e à diminuição da reatividade de ambas as frações após a ozonização (Galapate et al. 2001). Verificou-se que as ligações duplas C=C aromáticas diminuem após a ozonização quando os outros grupos funcionais C-H, C-O e O-H ainda estão presentes na água. A oxidação de grupos aromáticos permite a redução de THM-UFC.
Neste contexto, investigamos o impacto da ozonização na redução de subprodutos da cloração em estações de tratamento de água potável (ETAs) na província de Quebec usando um processo de ozonização como parte de sua estratégia de tratamento. Os principais objetivos deste projeto foram (i) caracterizar a oxidação de precursores de DBPs em ETAs de Quebec usando ozônio e (ii) relacionar o desempenho do ozônio às características de NOM e condições de ozonização. Para atingir esses objetivos, foram realizadas campanhas de amostragem em quinze ETAs localizadas em toda a província de Quebec (Canadá). As amostras foram coletadas antes e após a ozonização em escala real e cloradas em laboratório para a realização das medidas de DBPs sob testes UFC. Uma ozonização em escala laboratorial também foi realizada em cada amostra para padronizar as condições de ozonização de todas as águas investigadas.
Material e Métodos
Produtos Químicos e Reagentes
Todos os produtos químicos eram produtos comerciais do mais puro grau, a menos que especificado de outra forma. Os padrões de misturas THM e HAA foram fornecidos pela Supelco Analytical (EUA) e certificados pela American Chemical Society (ACS). A solução padrão de brometo foi adquirida da Fluka (Seelze, Alemanha), certificada TraceCERT, e o padrão de bromato foi obtido da SPEX certprep (Metuchen, NJ, EUA). Todas as soluções foram preparadas em água deionizada a partir de um dispositivo Millipore (Milli-Q Gradient, Millipore, Molsheim, França). Todos os vidros foram limpos com solução concentrada de cloro (1 mM) antes do uso.
Estações de Tratamento de Água Investigadas
Um total de 15 concessionárias de água abastecidas por diferentes fontes de água participaram deste estudo. Isso representa cerca de 36% das ETAs de Quebec usando ozonização como parte de seu tratamento. Os locais mais comuns para o processo foram respectivamente pós-ozonização (9), ozonização intermediária (3) e pré-ozonização (3). As principais etapas dos processos de tratamento de água são relatadas na Tabela 1.
Campanhas de Amostragem
As campanhas de amostragens foram replicadas para cada ETA em águas mornas (junho a agosto de 2011) e águas frias (novembro de 2011 a abril de 2012). Cada campanha de amostragem consistiu na coleta de amostras de água antes e depois da ozonização em garrafas de polipropileno previamente enxaguadas com água de amostragem. As amostras foram transportadas dentro de 24h para o laboratório em refrigeradores contendo bolsas de gelo.
TABELA 1 – Principais Etapas dos Processos de Tratamento de Água em Estações

Pós: Pós-ozonização, Inter: Ozonização intermediária, Pré: Pré-ozonização.
RW: Água bruta.
P6: O sistema de ozonização não funcionou no período de amostragem.
Ensaios de Ozonização no Laboratório
Testes de ozonização também foram realizados em escala laboratorial para estudar a influência do ozônio em condições controladas. Para cada campanha de amostragem, uma amostra de água antes da ozonização foi coletada e ozonizada em um reator de batelada verdadeiro de 2 L equipado com uma tampa flutuante de Teflon. A condição de ozonização foi padronizada em 1,0 mg O3 mg−1 DOC e 22°C. Consequentemente, as dosagens de ozônio aplicadas em escala laboratorial variaram de 1,7 a 7,1 mg O3 L−1 com um valor médio de 3,0 mg L−1. Uma solução de estoque de ozônio (~60 mg O3 L-1) foi produzida por ozônio borbulhante produzido por um gerador de ozônio alimentado com oxigênio (gerador de ozônio TG-10 da Ozone Solutions, EUA) em água ultrapura. No tempo 0, uma alíquota desta solução de reserva foi injetada no reator em lote e o decaimento de ozônio foi monitorado usando o método índigo-trissulfonato (4500-O3), conforme descrito em Métodos Padrão (1998).
Parâmetros Gerais de Qualidade da Água
As características da amostra in situ (pH, temperatura, alcalinidade e turbidez), bem como as condições de ozonização (dosagem de ozônio, tempo de contato) foram fornecidas pelas concessionárias de água participantes. No laboratório, as medições de pH e turbidez foram realizadas com um medidor de pH Fisher Meter Accumet AB15 e um turbidímetro Hach 2100AN, respectivamente.
A matéria orgânica natural (NOM) foi caracterizada usando carbono orgânico dissolvido (DOC), carbono orgânico dissolvido biodegradável (BDOC), absorbâncias de UV em 254 nm e 272 nm e absorbância específica (SUVA). As absorbâncias foram medidas com um espectrofotômetro Ultrospec 3100 pro (Biochrom, Reino Unido) ou Varian (Cary 100 Scan) usando uma célula de comprimento de caminho de 1 ou 2 cm. A absorbância diferencial em 272 nm foi definida pela relação:
ΔAλ272 = Aapós a cloração –Aantes da cloração
(Korshin et al. 2002, 2007). Neste estudo a cloração foi realizada com águas ozonizadas e não ozonizadas. DOC e BDOC foram determinados pelos métodos APHA et al. (1998) e Servais et al. (1987), respectivamente.
Simulação de formação de THM e HAA
A formação de quatro trihalometanos (TTHM): clorofórmio (CF), bromodiclorometano (BDCM), dibromocloremetano (DBCM) e bromofórmio (BF) e seis ácidos haloacéticos (HAA6): ácido monocloroacético (MCA), ácido dicloroacético (DCA), ácido tricloroacético (TCAA), ácido monobromoacético (MBA), ácido dibromoacético (DBA) e o ácido bromocloroacético (BCA) foram realizados de acordo com a condição de formação uniforme desenvolvida por Summers et al. (1996). É um método padronizado de simulação da formação de subprodutos de desinfecção aproximando-se das condições comumente encontradas em sistemas de distribuição de água.
Assim, a formação de THM4 e HAA6 foi medida após 24 h de incubação a 22 ± 1°C e pH 8,0 ± 0,2 (mantido constante com tampão fosfato). O Cloro foi aplicado para atingir uma concentração residual livre de 1,0 ± 0,4 mgL−1 após 24 h. Três estações realizaram a cloração antes da ozonização, amostras não ozonizadas foram coletadas para se ter uma medição direta das concentrações de fundo de THMs e HAA6 que foram subtraídas do THM-UFC e HAA6-UFC.
O cloro residual foi determinado de acordo com o método colorimétrico N, N-dietil-p-fenilenodiamina (DPD) dos Métodos Padrão APHA (1998). A demanda de cloro foi calculada como a diferença entre o cloro residual livre após 5 min de tempo de contato (demanda imediata devido à presença de compostos de cloro altamente reativos) e a concentração determinada após 24 h. É expresso como Cl2 = [Cl2] (5min) – [Cl2] (24 h).
Os THMs foram analisados com o método de extração líquido-líquido derivado de Koch et al. (1988) e os Métodos Padrão APHA et al. (1998) (método 6232B). Neste método, 4 mL de hexano (solvente de extração contendo 60 µg/L de 1,2-dibromopropano como padrão interno) são adicionados a 20 mL de amostra. Em seguida, 5 g de sulfato de sódio (Na2SO4) foram adicionados e agitados em vórtex por 30 s. Uma alíquota do sobrenadante foi transferida para um frasco de GC. As concentrações de HAA6 foram medidas de acordo com a extração líquido-líquido e método de derivatização 552.2 da US EPA (1995). O composto 1,2-dibromopropano também foi usado como padrão interno.
Os DBPs foram quantificados com uma cromatografia gasosa Varian CP 3800 (GC) equipada com um detector de captura de elétrons Varian (ECD) e um amostrador automático Varian 8400. A coluna analítica capilar foi uma RTX-5MS com filme de 0,25 µm, diâmetro interno de 0,25 mm e 30 m de comprimento. Para todos os DBPs, a temperatura do detector foi de 300°C, o volume de injeção foi de 1,0 µL no modo split. A temperatura do injetor foi mantida em 110°C e 150°C para THMs e HAA6, respectivamente. O Hélio foi usado como gás de arraste (fluxo: 1,5 mL min-1) e o gás de complementação (make up) foi uma mistura de argônio 95% e metano 5% (vazão: 28 mL min-1). Para THMs, a temperatura da coluna foi mantida a 28°C por 3 min. Ela foi aumentada para 45°C na taxa de 1,5°C min-1, então aumentada para 49°C na taxa de 1°C min-1 e para 110°C em 10°C min-1 por 3 min. De acordo com HAA6, a coluna foi mantida a 29°C por 10 min, aumentada de 1°C min-1 a 37°C por 3 min, aumentada para 40°C em 1°C min-1 por 3 min e aumentada de 11 °C min−1 a 136 °C por 3 min, depois aumentou para 150 °C à taxa de 20 °C min−1, mantida por 3 min. Cada amostra foi analisada em duplicata e a média das medidas foi calculada.
Análise de Brometo e Bromato
As concentrações de brometo (BrO−) e bromato (BrO3−) foram medidas usando o método EPA 326 (US EPA 2002). Ambos os ânions foram analisados com Cromatografia Iônica de Sistema Duplo Dionex ICS-3000 (Dionex Corporation, Sunnyvale, CA, EUA). O sistema era composto por uma bomba dupla (DP), um detector de condutividade ASRS 300 (4 mm) suprimido com um supressor ASRS 300 (4 mm) operando a 70 mA dentro de um compartimento detector/cromatografia (DC), um gerador de eluente (EG) com CR-ATC, um Detector de Comprimento de Onda Variável UltiMate 3000 (VWD) ajustado em 214 nm. Foi utilizado um Dionex, IonPac AS18 (4 × 250mm) ajustado a 30°C, com sua respectiva coluna de guarda AG18 (4 × 50 mm).
O eluente (1,3 mL min-1) foi uma solução de carbonato de sódio 9,0 mM (Na2CO3). Em seguida, 500 µL de amostra foram injetados usando um amostrador automático AS40. O software de gerenciamento de cromatografia Chromeleon 6.8 foi usado para controle do sistema e processamento de dados. Para baixas concentrações de bromato, foi utilizado o método de detecção UV-Vis e a configuração IC descrita em outro lugar (Fotsing et al. 2011).
Caracterização da Matéria Orgânica Natural
As concentrações de carbono orgânico total e dissolvido (TOC e DOC) foram medidas com o método de oxidação por persulfato ultravioleta 5310C da Standard Methods usando um analisador Sievers 5310 C (Billerica, MA, EUA) equipado com um Sievers ICR (Inorganic Carbon Remover) e um amostrador automático Sievers 900.
Resultados
Qualidade da água não ozonizada
Algumas características das águas influentes de ozônio das ETAs são apresentadas na Tabela 2. Os valores de pH ficaram entre 5,90 e 8,22. O Carbono Orgânico Total (COT) foi composto principalmente de sua forma dissolvida (DOC). O BDOC constituiu entre 0 a 8,3% do DOC. As concentrações de brometo foram sempre inferiores a 30 µg/L (variou de 0 a 26 µg/L, média de 13 µ/L). Esses níveis eram baixos e não levavam a concentrações apreciáveis de bromato. Os valores de demanda de cloro obtidos durante os testes de UFC foram relativamente baixos (de 1 a 3,91 mg/L). THM-UFC e HAA-UFC variaram entre 42 e 225 µg/L, e 15 e 112 µg/L, respectivamente.
Em todas as estações, os níveis de THM-UFC foram 1,2 a 4 vezes (em média) maiores que HAA6-UFC. Esses resultados estão de acordo com os de Nissinen et al. (2002). Eles descobriram que as concentrações de THMs excederam as concentrações de HAA6 em 35 sistemas de abastecimento de água da Finlândia. Na água do lago Buyukcekmece (Turquia) Uyak e Toroz (2007) encontraram 238 µg/L para THM e 87 µg/L para HAAFP. Em contraste, Zhang et al. (2011) mostrou que os THMs foram 1,5 vezes maiores que o HAA6 em apenas uma das 13 fontes de água. Por outro lado, as concentrações de HAA6 podem ser 50% maiores do que THMs ou mais em algumas fontes de água (Krasner et al. 1989; Singer et al. 1995; Zhang et al. 2011). No entanto, a remoção de precursores de HAA por processos de tratamento de água é tipicamente mais eficiente do que para precursores de THM. Portanto, as concentrações de HAA em águas tratadas são tipicamente inferiores às concentrações de THM (Singer et al. 2002).
Tabela 2 – Características das águas influentes de ozônio das ETAs de acordo com o processo de ozonização (pré-ozonização (Pré), ozonização intermediária (Inter) e pós-ozonização (Pós)
*: Resultados dos testes UFC, pH = 8,0, T = 22°C, tempo = 24 h.
+: Antes dos testes do UFC.
NA: Não analisado.
Duas campanhas de amostragem foram realizadas em algumas plantas (n = 2).
Influência do Ozônio nas Características de NOM
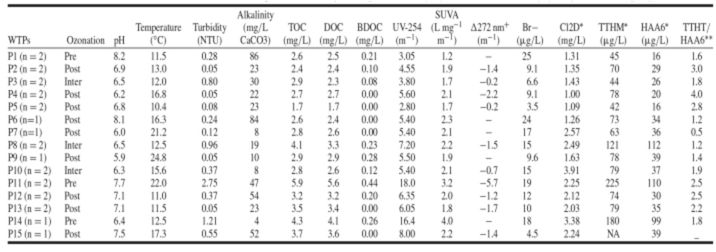
As quantidades e espécies de THM4 e HAA6 formadas durante os processos de tratamento de água são fortemente dependentes das características de NOM e concentração de brometo. A ozonização resultou em uma redução relativamente grande na absorbância de UV em 254 nm (48 e 60% em média em escala total e de laboratório, respectivamente) (Figura 1a). Para todas as estações investigadas (com exceção de P11) DOC (e TOC, não mostrado) não foi impactado marginalmente pela ozonização (Figura 1b). A porcentagem de redução variou de 0 a 19% após a ozonização da estação e de 1,4 a 16% após a ozonização em escala laboratório. Em sistemas em escala real, a planta P11 exibiu uma remoção de DOC muito alta durante a pré-ozonização (46% na primeira campanha de amostragem e 57% na segunda). Isso pode ser devido ao alúmen que foi injetado no processo de pré-ozonização. Consequentemente, a ozonização não resultou em nenhuma mineralização apreciável da matéria orgânica. No entanto, o aumento substancial da fração BDOC (Figura 1c) indica que a porção hidrofílica formada pela ozonização é biodegradável. Finalmente, uma diminuição na SUVA (a razão de UV-254 para DOC) foi obtida após a ozonização (Figura 1d). Isso confirma a transformação preferencial da estrutura aromática.
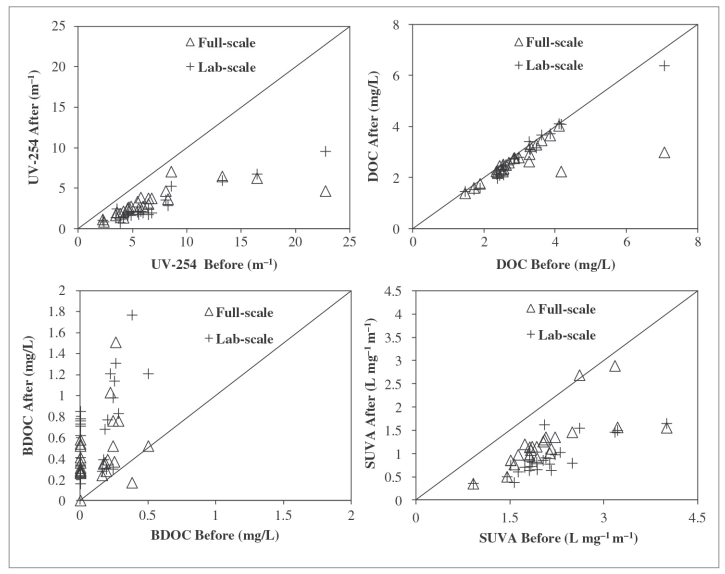
Figura 1 – Efeito do ozônio nas características de NOM (a) UV-254, (b) DOC, (c) BDOC, (d) SUVA em experimentos de ozonização em escala real e em escala de laboratório.
Efeito do Ozônio na Formação DBP-UFC
A Figura 2 apresenta o efeito da ozonização na remoção de THM-UFC e HAA-UFC. O desempenho em larga escala tem origens nas condições de ozonização específicas do local (ou seja, temperatura e dosagens variáveis da água). Para as estações onde havia valores disponíveis (9 estações), as dosagens de ozônio aplicadas variaram de 0,60 a 3,30 mg/L (média: 1,64 mg/L) representando uma razão O3:DOC de 0,17 a 1,58 mg/L O3/mg DOC (média: 0,68 mg/L O3/mg DOC). Em experimentos em escala de laboratório, a dose de ozônio foi fixada em 1 mg O3/mg DOC. Isso correspondeu a maiores dosagens de O3 variando entre 1,44 e 7,08 mg/L de O3 (média: 3,03 mg/L).
Em geral, a ozonização levou a uma melhor redução de HAA6-UFC do que TTHM-UFC. As concentrações médias foram de 59 µg/L (de 27 a 102 µg/L) para THM-UFC e 27 µg/L (de 1,5 a 113 µg/L) para HAA-UFC nas estações. Nessas condições, as taxas de eliminação de THM-UFC e HAA-UFC chegaram a 77 e 82%, respectivamente. As taxas médias de redução foram de 27% e 32%. Além disso, notamos aumentos insignificantes em precursores para estações P5 para THM e P5 e P13 para HAA. Os maiores aumentos foram de 4% para THM e 5% para HAA na estação P5. No geral, 14% das amostras ozonizadas em escala real levaram a um aumento na formação de DBP-UFC.
Para condições de ozônio em laboratório, a taxa de eliminação de THM-UFC e HAA-UFC foi em média de 9 e 30%, respectivamente. Essa diferença de desempenho foi estatisticamente significativa (p = 0,0003). Além disso, as reduções de THM também foram estatisticamente menores (p = 0,002) do que as observadas para condições de ozônio em escala real, embora as dosagens de ozônio fossem maiores. No entanto, os desempenhos em escala de laboratório e em escala real do HAA-UFC não foram estatisticamente diferentes (p = 0,696). Para ozonização em escala de laboratório, um aumento nas concentrações de THM-UFC (3 a 16%) e HAA6-UFC (8 a 14%) foi observado em 33% e 13% das estações, respectivamente.
Curiosamente, quatro das cinco ETAs que apresentaram aumento na formação de THM após a ozonização (P3, P4, P5, P12 e P13) eram estações pós-ozonização. Além disso, as águas de P5 e P13 foram cloradas antes da ozonização. Portanto, a maioria dos locais reativos já havia reagido com cloro antes da ozonização. Isso reforça a conclusão de que a ozonização de águas com baixo DOC é mais vulnerável a levar ao aumento da formação de DBP se a dosagem de O3:DOC for muito alta.
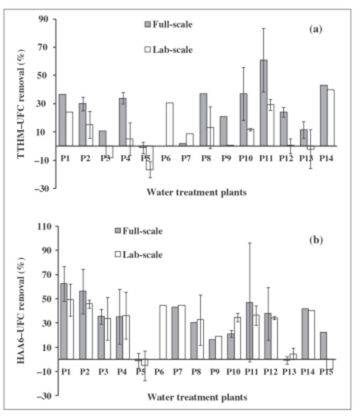
Figura 2 – Percentual de redução de TTHM-UFC (a) e HAA6-UFC (b) após ozonização em escala real e em escala de laboratório.
As barras de erro representam o desvio padrão relativo (média, n = 2) de duas campanhas de amostragem sazonal.
Especiação de THM e HAA6
Antes da ozonização, o CF era o principal subproduto do THM-UFC com contribuições variando de 62 a 100% (média de 89%). Foi seguido pelo BDCM com média de 10%. Para HAA-UFC, DCA e TCA foram encontrados com média de 48% e 50% da concentração total. Esses resultados estão de acordo com um estudo anterior (Rodriguez et al. 2007) realizado na cidade de Quebec, que mostrou que o FC compunha 65–98% da TTHM, enquanto o DCA e TCA combinados totalizavam 96–98% da HAA6. Especificamente para P1, o DBCM foi detectado (4 µg/L) em água não ozonizada (resultados não mostrados). A ozonização resultou em aumento (40%) após condições plenas e uma diminuição (32%) após experimentos em escala de laboratório. As proporções de TTHM foram de 19 e 8%, respectivamente. O BF inicialmente não detectado, foi ligeiramente formado após ozonização em escala real (2 µg/L, 6% de TTHM) e em escala de laboratório (3 µg/L, 10% de TTHM).
O BCA e DBA foram os dois HAA-UFC bromados detectados em níveis geralmente baixos. Isso pode ser explicado pelas baixas concentrações de brometo nas águas estudadas levando a níveis muito baixos de bromatos (muitas vezes abaixo do limite de quantificação e valor máximo de 18 µg/L) detectados após a ozonização.
Em geral, a ozonização resultou em uma diminuição significativa na formação de clorofórmio em O3 em escala real (p = 0,024), mas nenhuma mudança significativa na concentração foi observada após a escala de laboratório O3 (p = 0,373). No entanto, o CF continua a ser a fração predominante de THM-UFC (de 89% antes da ozonização para 85% após escala real de O3 e 88% após escala de laboratório de O3). Nenhuma variação estatisticamente significativa foi observada no BDCM-UFC, que representou 10% do THM-UFC antes da ozonização e 13 (ou 10%) após o O3 em escala real (ou O3 em escala de laboratório). Quanto ao HAA-UFC, DCA e TCA compreendiam 48 e 50% antes da ozonização. Essas proporções não foram alteradas após o O3 em escala real (p > 0,050), mas houve aumento do DCA (66%, p = 0,0002) e diminuição do TCA (33%, p = 0,003) após O3 em escala laboratorial. As proporções dos principais DBPs formados em todas as águas são mostradas na Tabela S1 do Material Suplementar.
Correlações DBP-UFC com Demanda de Cloro (Cl2D)
Foram examinadas as correlações entre a formação de subprodutos da cloração e as características da água. Entre todos os parâmetros testados, a demanda de NOM-cloro apresentou as maiores correlações (R2 = 0,68 – 0,82) com THM-UFC (Figura 3). De fato, as inclinações da regressão mostraram que cada mg de cloro consumido levou à formação de 38,6 ± 6,0 µg TTHM antes da ozonização. Após a ozonização em escala real, essa relação foi reduzida para 24,9 ± 4,0 µg THM-UFC/mg Cl2, o que corresponde a uma redução de 36%. Por outro lado, a ozonização em escala de laboratório produziu uma reatividade de 41,2 ± 4,5 µg THM/mg Cl2, que não foi estatisticamente diferente do medido em águas não ozonizadas. Este resultado confirma que as condições de ozonização mais severas aplicadas em escala de laboratório não apenas destruíram os locais reativos ao cloro, mas também geraram novos, de tal forma que a demanda de cloro não foi alterada significativamente.
Em relação à HAA, verificou-se que a demanda de cloro estava razoavelmente bem correlacionada com a formação de HAA-UFC em águas não zoneadas (R2 = 0,64) e após ozonização em escala de laboratório (R2 = 0,61). No entanto, as tendências observadas foram semelhantes aos dados de THM: a ozonização em escala real reduziu o rendimento de HAA melhor do que a ozonização em escala de laboratório. A principal diferença com o THM parece ser que o ozônio foi mais eficaz na redução de HAA do que as concentrações de THM.

Figura 3 – Correlação entre DBP-UFC e demanda de cloro (i) antes, (ii) após a ozonização em escala real ou (iii) em escala de laboratório.
Correlações DBP-UFC com Demanda Imediata de Ozônio (IOD)
Durante os ensaios de ozonização em escala de laboratório, foram medidas as meias-vidas do ozônio dissolvido e as demandas imediatas de ozônio (IOD). O IOD é definido como o consumo rápido inicial de ozônio durante aproximadamente os primeiros 20 s de ozonização (Buffle et al. 2006; Cho et al. 2003; Hoigné e Bader 1994; Parketal. 2001). Para este trabalho, o IOD foi calculado como a diferença entre a dosagem aplicada e a concentração inicial de ozônio prevista pela regressão de um decliniode primeira ordem nos dados de ozônio versus tempo. O IOD foi então normalizado dividindo-o pela dosagem de O3 aplicada (por exemplo, e IOD de 1,0 mg/L para uma dosagem de 3,0 mg/L produz um IOD padronizado de 33%). As reduções de THM e HAA (em %) foram correlacionadas com IOD.
O IOD foi correlacionado apenas com a redução de THM, conforme mostrado na Figura 4. Os valores de R2 (0,55) e p (<0,05) da correlação indicaram que o IOD levou à redução do THM-UFC.
Curiosamente, os baixos valores de IOD (<~15%) foram sugestivos de ozonização levando ao aumento da formação de THM-UFC. A maioria das águas teve valores de IOD incluídos entre 20 e 40%, mas algumas podem chegar até 60% no caso de pré-ozonização. As maiores taxas de IOD observadas em nosso estudo (61 e 60%) correspondem às maiores concentrações de ozônio adicionado, 7,08 e 4,23 mg/L, respectivamente, e consequentemente também às maiores concentrações de DOC.
Impacto do Tipo de Ozonização na Remoção de DBP-UFC
A Figura 5 mostra que a cloração das águas antes da pré-ozonização leva à formação de uma grande quantidade de THMs. O valor mediano foi de 161 µg/L comparado a 89 e 71 µg/L para águas assentadas (antes da inter-ozonização) e filtradas (antes da pós-ozonização), respectivamente.
A taxa média de redução após a pré-ozonização completa correspondente foi de 50%, um desempenho significativamente diferente dos 18% observados para a pós-ozonização (p = 0,002). No entanto, não foi estatisticamente diferente do desempenho médio da interozonização (média de 30%, p = 0,16). Da mesma forma, o desempenho da inter e pós-ozonização não foi significativamente diferente (p = 0,17).
A taxa média de redução após a pré-ozonização em escala real correspondente foi de 50%, um desempenho significativamente diferente dos 18% observados para a pós-ozonização (p = 0,002). Entretanto, não foi estatisticamente diferente do desempenho médio da interozonização (média de 30%, p = 0,16). Da mesma forma, o desempenho da inter e pós-ozonização não foi significativamente diferente (p = 0,17).
A pré-ozonização em condições de laboratório foi mais eficaz do que em condições de escala real. A taxa média de redução foi de 31%. Foi apenas 8% (p = 0,013) após a interozonização e 3% (p = 0,002) após a pós ozonização. As taxas de eliminação inter e pós-ozonização não foram estatisticamente diferentes (p = 0,49).
Para HAA6-UFC, as concentrações medias foram bastante semelhantes antes da ozonização em escala real (43, 38 e 30 µg/L para águas brutas, assentadas e filtradas, respectivamente). As reduções médias foram de 52%, 29% e 26%, após pré, inter e pós-ozonização, respectivamente. Uma observação semelhante foi feita em experimentos de ozonização em escala de laboratório, onde as reduções foram de 42%, 34% e 24% após pré, inter e pós-ozonização, respectivamente. Para as reduções de HAA-UFC, os desempenhos em escala real e em escala de laboratório não foram estatisticamente diferentes (p > 0,05).
Figura 4 – Relação entre a taxa de redução de TTHM e a demanda imediata de ozônio como % da dosagem de ozônio em experimentos em escala de laboratório.

Figura 5 – Efeito da pré-, intermediária (inter-) e pós-ozonização na redução de TTHM-UFC e HAA6-UFC em águas ozonizadas em escala real e em escala de laboratório.
Relação entre DBP-UFC e A272
A concentração de DBPs formados antes da ozonização em função de -ΔA272 é relatada na Figura 6. A correlação THM-UFC vs -ΔA272 (para 7 plantas) foi forte e linear (Figura 6a). Esta relação está principalmente associada ao CF que representa 88% (em média) do total de THM-UFC nas águas estudadas. Para HAA e seus principais componentes TCA (50%) e DCA (48%) as correlações (para 10 plantas) não foram significativas (Figura 6b). Após a ozonização em escala real, DBP vs -ΔA272 apresentou correlações fracas (valores de R2 compreendidos 0,19 e 0,63 e p > 0,05). As relações lineares são mostradas na Figura S1 no Material Suplementar.
Os gráficos de DBPs e -ΔA272 após ozonização em escala de laboratório são mostrados na Figura S2. Quanto às águas não ionizadas, TTHM-UFC, CF e HAA6-UFC, DCA e TCA não foram bem correlacionados com -ΔA272. Além disso, neste caso (como após experimentos em grande escala) os valores de -ΔA272 foram muito baixos (de um negativo a um máximo de 0,8 m−1) em oposição aos calculados antes da ozonização (valores positivos e máximo de 2,2 m−1)
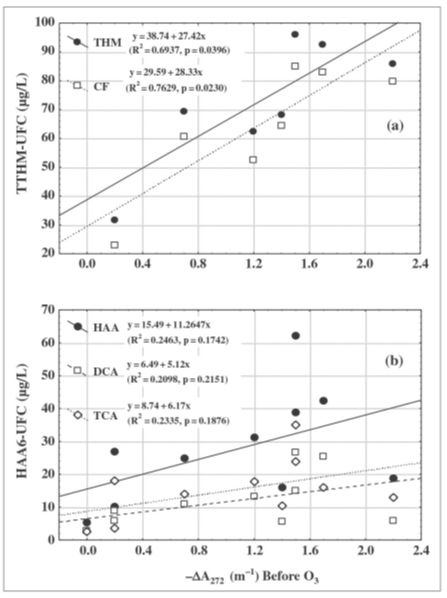
Figura 6 – Relação entre a absorbância diferencial e a 272 nm TTHM-UFC (a, n = 7)
e HAA6-UFC (b, n = 10) antes da ozonização.
Discussão
A redução de THM-UFC e HAA6-UFC após a ozonização é consistente com o trabalho de muitos pesquisadores que observaram que a ozonização geralmente leva a uma diminuição da formação de DBPs clorados (Langlais et al. 1991; Trussell e Umphres 1978). Este processo é conhecido por levar à formação de compostos biodegradáveis de baixo peso molecular devido à clivagem de anéis aromáticos e ligações carbono-carbono insaturadas (Buchanan et al. 2006; Hua e Reckhow 2013; Zhang e Minear 2002). Além disso, os grupos fenólico-OH mostraram ter um efeito positivo na formação de THMFP, aumentando a reatividade de algumas porções aromáticas de NOM em relação ao cloro. Um decréscimo nestas porções irá, consequentemente, diminuir o THMFP (Galapate et al. 2001).
A destruição de compostos de alto peso molecular (mais abundantes em águas brutas) poderia explicar a eficácia da pré-ozonização em escala real para o controle de TTHM-UFC observada neste estudo. Este resultado concorda com os relatados por autores anteriores (Chang et al. 2002; Hua e Reckhow 2013; Teksoy et al. 2008; Wert e Rosario-Ortiz 2011). No entanto, uma grande fração da redução da formação de DBP origina-se do NOM hidrofóbico de carga negativa, que pode ser efetivamente reduzido pelo processo de coagulação subsequente. Além disso, a pré-ozonização deve ser aplicada com cautela. Por exemplo, Chang et al. (2002) observaram um aumento em THMFP de 58% quando a pré-ozonização foi realizada por 10 min. Mais recentemente, Hua e Reckhow (2013) descobriram que o THMFP na água da cidade de Dallas aumentou 6% após a pré-ozonização. Esta fonte de água apresentou o menor valor de SUVA (1,7 L/mg/m) de todas as águas testadas.
Observou-se que o impacto do ozônio na formação do BDOC é em grande parte específico da água. É interessante lembrar que um limiar de 0,16mgC/L foi identificado por Servais et al. (1995) como um limite para evitar o consumo de BDOC dentro de um sistema de distribuição. Para a formação de bromato, pode se tornar um problema quando as concentrações de brometo estão acima de 50 – 100 µg/L (Von Gunten 2003).
O aumento variável nas concentrações de DBP-UFC observado em algumas estações pode ter várias origens. Compostos biodegradáveis de baixo peso molecular formados após a ozonização podem conter locais mais reativos causando a formação de THMs durante a cloração (Marhaba e Van 2000). De acordo com Teksoy et al. (2008), tal aumento possivelmente se deve, ao menos parcialmente, à formação de aldeídos por ozonização. Da mesma forma, a ozonização pode levar à hidroxilação de compostos aromáticos para produzir derivados aromáticos m-diidroxi, que são conhecidos como precursores de THM (Siddiqui et al. 1997).
Além disso, a ozonização da água contendo matéria orgânica natural leva à formação de aldeídos e cetonas, subprodutos estáveis (Reckhow et al. 1993; Siddiqui et al. 1997) capazes de reagir com cloro (Reckhow et al. 1993) para gerar e aumentar a quantidade de subprodutos clorados.
A ozonização mostrou ter efeitos variáveis na oxidação de precursores de THM e HAA. A alta variabilidade das características da água, principalmente a natureza da matéria orgânica natural é certamente uma das razões para tal resultado. Outra causa para a variação observada no desempenho está relacionada ao impacto do brometo na formação de DBP. Com exceção de P3, o BDCM estava presente em todas as águas após a ozonização, com concentrações atingindo até 12 µg/L (média de 7 µg/L) e 15 µg/L (média de 8 µg/L) após a ozonização em escala real e laboratorial, respectivamente. Em condições de escala real, a ozonização foi mais eficaz na redução de CF do que o BDCM (p = 0,0009).
Nenhuma diferença significativa foi obtida em condições de escala de laboratório (p = 0,693). A redução de precursores de BDCM foi menos impactada do que para CF. As concentrações dessas formas bromadas após a ozonização foram inferiores à concentração máxima aceitável (16 µg/L) recomendada pela Health Canada (2006). Valores mais altos teriam sido uma preocupação porque as espécies bromadas são bem conhecidas por serem mais tóxicas do que os DBPs de cloro com substituição (Chisholm et al. 2008; Richardson 2003; Warne et al. 1999). Para DCA e TCA as taxas de redução não foram estatisticamente diferentes (p < 0,05).
Como esperado, TTHM-UFC e HAA6-UFC mostraram-se linearmente dependentes da demanda de cloro. Com exceção de HAA6-UFC (R2 = 0,19 e coeficiente de rendimento = 11 µg HAA6/mg Cl2) após ozonização em escala de laboratório, ambos os grupos DBP tiveram coeficientes de rendimento relativamente altos (variando de 28 a 41 µg TTHM a HAA6/mg Cl2 consumido). Gang et al. (2002) e Gang et al. (2003) obtiveram rendimentos variando de 31 a 48 TTHM µg/mg Cl2 (média de 38 µg/mg Cl2) para THMs e de 22 a 27 HAA9 µg/mg Cl2 (média de 25 µg/mg Cl2). No entanto, eles mediram THMs e a demanda de cloro após 120 h de incubação a 25°C sem ozonização prévia.
O DBP-UFC e algumas espécies individuais de DBP foram bem correlacionadas com -ΔA272 antes da ozonização e após a ozonização em escala de laboratório. Em estudos anteriores, a absorbância diferencial em 272 nm mostrou estar fortemente correlacionada com a concentração de alguns DBPs (Korshin et al. 1997; Korshin et al. 2002; Roccaro et al. 2008; Roccaro e Vagliasindi 2009).
Verificou-se que a formação de TTHM (Roccaro et al. 2008) e DCA (Korshin et al. 2002) não era dependente do pH ao contrário do CF e TCA (Korshin et al. 2002). No entanto, o estudo de Roccaro et al. (2008) também mostrou que a correlação foi forte, mas não necessariamente linear.
A cloração resultou em uma diminuição da absorbância de NOM. Assim, ΔA272 é sempre negativo (Korshin et al. 2002). Para os valores positivos observados, provavelmente foi porque a reação do ozônio com o NOM gerou produtos de transformação que ainda absorvem em 272 nm, como hipotetizado por Nöthe et al. (2009) e Audenaert et al. (2013). Além disso, esses subprodutos provavelmente foram menos reativos com o cloro livre após a ozonização (Wert e Rosario-Ortiz 2011). No entanto, as águas correspondentes em nosso estudo não apresentaram valores mais baixos de DBP-UFC.
Ates et ai. (2007) supõem que porções NOM que não absorvem a luz UV também podem desempenhar um papel importante na formação de DBPs. Isso explicaria por que nossas condições de ozonização em escala de laboratório, que mostraram as maiores reduções de UVA, não se traduziram nas maiores reduções na formação de DBP. A utilização do ΔA272 (ou UVA254) sofre com a incapacidade de capturar a formação de novos locais reativos. Consequentemente, esses indicadores são melhor aplicados em águas cloradas que não sofreram ozonização. Recentemente, Yan et al. (2014) propôs o uso de Δlog (A350) como um melhor preditor do que ΔA272. Essa estratégia também foi testada, mas não se mostrou superior ao uso de ΔA272 (dados não mostrados).
Reações diretas de ozônio com porções NOM e alguns compostos inorgânicos ocorrem durante a fase inicial de ozonização (Buffle e Von Gunten 2006). Demonstrou-se que isso resulta em concentrações transitórias muito altas de • HO e, portanto, desempenha um papel essencial em muitos processos, como formação de bromato ou oxidação de contaminantes farmacêuticos (Buffle et al. 2004; Buffle et al. 2006; Parketal.2001). Em experimentos com reatores em lote, Cho et al. (2003) mostraram que o IOD de duas águas de rios coreanos (pH fixado em 7, alcalinidade < 10 mg/L como CaCO3) foi responsável por mais de 40% do consumo de ozônio aplicado, que variou de 0,26 a 0,29 mg/mg do DOC. Eles também descobriram que mais de 40% do IOD de dois ácidos húmicos comerciais veio da reação de ozônio mediada por •OH.
Antes de 20 s de reação, uma proporção semelhante foi calculada por Buffle e Von Gunten (2006) com águas do Lago Zurique (tamponadas em pH 8 e alcalinidade de 2,4 mM ou 240 mg/L como CaCO). Considerando essas observações, parece lógico que o IOD esteja correlacionado com o desempenho do ozônio na redução da formação de DBP. As águas com baixo IOD (por exemplo, <15%) têm baixas frações hidrofóbicas e, portanto, são mais vulneráveis a sofrer maior formação de DBP após a ozonização, especialmente se a dosagem de O3/C for alta. Outros estudos devem avaliar se as medições on-line de IOD podem oferecer um método específico do local para controlar o desempenho do ozônio, especialmente para sistemas de pré-ozonização para os quais grandes variações sazonais de IOD podem ser esperadas.
Conclusões
Os resultados do presente estudo mostram o efeito variável da ozonização na formação de DBPs em várias águas superficiais de Quebec. Concentrações médias de TTHM e HAA6 de 89,4 e 45,3 µg/L, respectivamente, foram obtidas a partir de testes UFC com águas não ozonizadas. Em geral, a ozonização resultou em um impacto significativo e favorável na redução do DBP-UFC na condição de escala real (27 e 32% para TTHMUFC e HAA6-UFC, respectivamente). Após uma ozonização mais rigorosa em escala de laboratório, os desempenhos foram inferiores para TTHM (9%) e semelhantes para HAA6 (30%). As maiores dosagens de ozônio aplicadas em laboratório mostraram-se desfavoráveis para a remoção de precursores de TTHM.
Devido às baixas concentrações de brometo nas águas em estudo, níveis muito baixos de bromatos foram detectados após a ozonização. Para BDOC, observou-se um aumento substancial que foi em grande parte específico da água. Concentrações médias de 0,13, 0,46 e 0,69 mg C/L foram determinadas antes e após experimentos em escala real e de laboratório, respectivamente.
A absorbância diferencial em 272 nm mostrou limitações em sua capacidade de prever a formação de DBP após a ozonização. A demanda de cloro e a demanda imediata de ozônio foram respectivamente encontradas para fornecer melhores indicações sobre a extensão da formação de DBP e o desempenho esperado do ozônio na redução de precursores de DBP. Em todos os casos, as dosagens de ozônio devem ser otimizadas para evitar o aumento da formação de DBP (especialmente THM) após a ozonização.
Agradecimentos
Agradecemos a Jacinthe Mailly, Julie Philibert, Mireille Blais e Yves Fontaine por sua ajuda no trabalho de laboratório.
Financiamento
Este estudo foi financiado pela Natural Sciences and Engineering Research Council of Canada (NSERC) sobre Água Potável da École Polytechnique de Montréal e do Islamic Development Bank (Merit Scholarship Programm for High Technology)
Material Suplementar
Dados suplementares para este artigo podem ser acessados no site da editora.
Referências
Ates, N., M. Kitis, and U. Yetis. 2007. “Formation of Chlorination By-products in Waters with Low SUVA-Correlations with SUVA and Differential UV Spectroscopy.” Water Res. 41: 4139–4118.
Audenaert, W.T.M, D. Vandierendonck, S.W.H. Van Hulle, and I. Nopens. 2013. “Comparison of Ozone and HO• Induced Conversion of Effluent Organic Matter (EfOM) Using Ozonation and UV/H2O2 Treatment.” Water Res. 47: 2387–2398.
Buchanan, W., F. Roddick, and N. Porter. 2006. “Formation of Hazardous By-products Resulting From Irradiation of Natural Organic Matter: Comparison Between UV and VUV Irradiation.” Chemosphere 63(7): 1130–1141.
Buffle, M.-O., S. Galli, and U. Von Gunten. 2004. “Enhanced Bromate Control During Ozonation: The Chlorine-Ammonia Process.” Environ. Sci. Technol. 38(19): 5187–5195.
Buffle, M.-O., J. Schumacher, E. Salhi, M. Jekel, and U. Von Gunten.2006. “Measurement of the Initial Phase of Ozone Decomposition in Water and Wastewater by Means of a Continuous Quench-Flow System: Application to Disinfection and Pharmaceutical Oxidation.” Water Res. 40(9): 1884–1894.
Buffle, M.-O., and U. Von Gunten. 2006. “Phenols and Amine Induced HO generation During the Initial Phase of Natural Water Ozonation.” Environ. Sci. Technol. 40(9): 3057–3063.
Chang, C.-N., Y.-S. Ma, and F.-F. Zing. 2002. “Reducing the Formation of Disinfection By-products by Pre-ozonation.” Chemosphere 46(1): 21–30.
Chisholm, K., A. Cook, C. Bower, and P. Weinstein. 2008. “Risk of Birth Defects in Australian Communities with High Levels of Brominated Disinfection By-products.” Environ. Health Perspect. 116(9): 1267–1273.
Cho, M., H. Kim, S.H. Cho, and J. Yoon. 2003. “Investigation of Ozone Reaction in River Waters Causing Instantaneous Ozone Demand.” Ozone: Sci. Eng. 25(4): 251–259.
Doré, M. 1989. “Chimie des Oxydants et Traitement des Eaux.” Tec. Doc. Paris: Lavoisier.
Fotsing, M., B. Barbeau, and M. Prevost. 2011. “Low-level Bromate Analysis in Drinking Water by Ion Chromatography with Optimized Suppressed Conductivity Cell Current Followed by a Post-Column Reaction and UV/Vis Detection.” J. Environ. Sci. Health, Pt. A 46(4): 420–425.
Galapate, R.P., A.U. Baes, and M. Okada. 2001. “Transformation of Dissolved Organic Matter During Ozonation: Effect on Trihalomethanes Formation Potential.” Water Res. 35(9): 2201– 2206.
Gang, D.D., E. Clevenger, and S.K. Banerji. 2003. “Relationship of Chlorine Decay and THMs Formation to NOM Size.” J. Hazard. Mater. 96(1):1–12.
Gang, D.D., R.L. Segar Jr., T.E. Clevenger, and S.K. Banerji. 2002. “Using Chlorine Demand to Predict TTHM and HAA9 Formation.” J. Amer. Water Works Asso. 94(10): 76–86.
Gazette Officielle du Québec. 2010. “Projet de règlement. Loi sur la qualité de l’environnement.” (L.R.Q., c. Q-2). 47: 4645–4662.
Health Canada. 2006. “Guidelines for Canadian drinking water quality: Guideline technical document —Trihalomethanes.”Water quality and health bureau, healthy environments and consumer safety branch, Health Canada, Ottawa, Ontario.
Hoigné, J., and H. Bader. 1994. “Characterization of Water Quality Criteria for Ozonation Processes. Part II: Lifetime of Added Ozone.” Ozone: Sci. Eng. 16(2): 121–134.
Hua, G., and D.A. Reckhow. 2013. “Effect of pre-ozonation on the formation and speciation of DBPs.” Water Res. 47: 4322– 4330.
Koch, B., E.W. Crofts, W.K. Schimpff, and M.K. Davis. 1998. “Analysis of Halogenated Disinfection By-products by Capillary Chromatography.” Proceedings of the American Water Works Association Water Quality Technology (AWWA-WQTC) Conference, Denver, Colorado, November.
Korshin, G.V., M.M. Benjamin, H.S., Chang, and H. Gallard. 2007. “Examination of NOM Chlorination Reactions by Conventional and Stop-Flow Differential Absorbance Spectroscopy.” Environ. Sci. Technol. 41: 2776–2781.
Korshin, G.V., C.-W. Li, and M.M. Benjamin. 1997. “The Decrease of UV Absorbance as Indicator of TOX Formation.” Water Res. 31(4): 946–949.
Korshin, G.V., W.W., Wu, M.M., Benjamin, and O. Hemingway. 2002. “Correlations Between Differential Absorbance and the Formation of Individual DBPs.” Water Res. 36: 3273–3282.
Krasner, S., M. McGuire, J. Jacangelo, N. Patania, K. Reagan, and E. Aieta. 1989. “The Occurrence of Disinfection By-products in US Drinking Water.” J. Amer. Water Works Asso. 81: 41–53.
Langlais, B., D.A. Reckow, and D.R. Brink. 1991. “Ozone in Water Treatment: Application and Engineering.” New York: American Water Works Association Research Foundation, Compagnie Générale des Eaux, Lewis Publishers.
Marhaba, T.F., and D. Van. 2000. “The Variation of Mass Disinfection By-products Formation Potential of Dissolved Organic Matter Fractions Along a Conventional Surface Water Treatment Plant.” J. Hazard. Mater. 74(3): 133–147.
Miltner, R.J., T.F. Speth, S.D. Richardson, S.W. Krasner, H.S. Weinberg, and J.E Simmons. 2008. “Integrated Disinfection By-products Mixtures Research: Disinfection of Drinking Waters by Chlorination and Ozonation/Postchlorination Treatment Scenarios.” J. Toxicol. Environ. Health Pt. A 71(17): 1133–1148.
Nissinen, T.K., I.T. Miettinen, P.J. Martikainen, and T. Vartiainen. 2002. “Disinfection By-products in Finnish Drinking Waters.” Chemosphere 48: 9–20.
Nöthe, T, H. Fahlenkam, and C. Von Sonntag. 2009 “Ozonation of Wastewater: Rate of Ozone Consumption and Hydroxyl Radical Yield.” Environ. Sci. Technol. 43: 5990–5995.
Park, H.-S., T.-M. Hwang, J.-W. Kang, H. Choi, and H.-J. Oh. 2001. “Characterization of Raw Water for the Ozone Application Measuring Ozone Consumption Rate.” Water Res. 35(11): 2607–2614.
Ran, Z., S. Li, J. Huang, C. Cui, and C.D. Williams. 2010. “Inactivation of Cryptosporidium by Ozone and Cell Ultrastructures.” J. Environ. Sci. 22(12): 1954–1959.
Reckhow, D.A. 1999. “Control of Disinfection By-Product Formation Using Ozone.” In Formation and Control of Disinfection By-products in Drinking Water, edited by Singer P.C. Denver, American Water Works Association, 179–204.
Reckhow, D.A., Q.-W. Zhu, J. Weiner, and A. MacNeill. 1993. “Effect of Ozonation on the Kinetics of DBP Formation.” Oral presentation, International Ozone Congress, San Francisco, California, August 31.
Richardson S.D. 2003. “Disinfection By-products and Other Emerging Contaminants in Drinking Water.” Trends Anal. Chem. 22(10): 666–684.
Roccaro, P., H.-S. Chang, F.G.A. Vagliasindi, and G.V. Korshin. 2008. “Differential Absorbance Study of Effects of Temperature on Chlorine Consumption and Formation of Disinfection Byproducts in Chlorinated Water.” Water Res. 42: 1879–1888.
Roccaro, P., and F.G.A. Vagliasindi. 2009. “Differential vs. Absolute UV Absorbance Approaches in Studying NOM Reactivity in DBPs Formation: Comparison and Applicability.” Water Res. 43(3): 744–750.
Rodriguez, M.J., J.-B. Sérodes, P. Levallois, and F. Proulx. 2007. “Chlorinated disinfection by-products in drinking water according to source, treatment, season, and distribution location.” J. Environ. Eng. Sci. 6(4): 355–365.
Rook, J.J. 1974. “Formation of Haloforms During Chlorination of Natural Waters.” Water Treat. Exam. 23(2): 234–243. Servais, P., G. Billen, and M. C. Hascoet. 1987. “Determination of the Biodegradable Fraction of Dissolved Organic Matter in Water.” Water Res. 21(4): 445–500.
Servais, P., P. Laurent, and G. Randon. 1995. “Comparison of the Bacterial Dynamics in Various French Distribution Systems.” J. Wat. SRT-Aqua 44(1): 10–17.
Siddiqui, M.S., G.L. Amy, and B.D. Murphy. 1997. “Ozone Enhanced Removal of Natural Organic Matter From Drinking Water Sources.” Water Res. 31(12): 3098–3106.
Singer, P.C., A. Obolensky, and A. Greiner. 1995. “DBPs in Chlorinated North Carolina Drinking Waters.” J. Amer. Water Works Asso. 87(10): 83–92.
Singer, P.C., H.S. Weinberg, S. Krasner, H. Aroa, and I. Najm. 2002. “Relative Dominance of HAAs and THMs.” In Treated Drinking Water, edited by American Water Association Research Foundation (AWWARF) and U.S. Environmental Protection Agency (U.S. EPA). Washington, DC: AWWARF-USEPA.
Song, R., R. Minear, P. Westerhoff, and G. Amy. 1999. “OzoneBromide Interactions with NOM Separated by XAD-8 resin and UF/RO Membrane Methods.” Edited by Minear R. A. and Amy G., Boca Raton, FL: Lewis Publishers, 223–254.
Staehlin, J., and J. Hoigné. 1985. “Decomposition of Ozone in Water in the Presence of Organic Solutes Acting as Promoters and Inhibitors of Radical Chain Reaction.” Environ. Sci. Technol. 19: 1206–1213.
Standard Methods for the Examination of Water and Wastewater, 20th Edition. 1998. Washington, DC: APHA, AWWA and WEF.
Summers, R.S., S.M. Hooper, H.M. Shukairy, G. Solarik, and D. Owen. 1996. “Assessing DBP Yield: Uniform Formation Conditions.” J. Am. Water Works Assoc. 80(6): 80–93.
S´wietlik, J., A. Da˛browska, U. Raczyk-Stanisławiak, and J. Nawrocki. 2004. “Reactivity of Natural Organic Matter Fractions with Chlorine Dioxide and Ozone.” Water Res. 38: 547–558.
Talbot, P., L. Martinelli, S, Talvy, E. Chauveheid, and B. Haut. 2012. “Ozone Inactivation of Resistant Microorganisms: Laboratory Analysis and Evaluation of the Efficiency of Plants.” Water Res. 46(18): 5893–5903.
Teksoy, A., U. Alkan, and S.B. Hüseyin. 2008. “Influence of the Treatment Process Combinations on the Formation of THM Species in Water.” Sep. Purif. Technol. 61(3): 447–454.
Trussell, R.R., and M.D. Umphres. 1978. “The formation of THMs.” J. Amer. Water Works Asso. 70(11): 604–612.
US EPA Method 326. 2002. “Determination of Oxyhalide Disinfection Byproducts in Drinking Water Using Ion Chromatography Incorporating the Addition of a Suppressor Acidified Postcolumn Reagent for Trace Bromate Analysis.” Document # EPA 815-R-03-007, Cincinnati, OH: US EPA, 1–47.
US EPA Method 552.2. 1995. “Determination of Haloacetic Acids and Dalapon in Drinking Water by Liquid-Liquid Extraction, Derivatization and Gas Chromatography with Electron Capture Detection.” Cincinnati, OH: US EPA.
Uyak, V., and I. Toroz. 2007. “Investigation of Bromide Ion Effects on Disinfection By-Products Formation and Speciation in na Istanbul Water Supply.” J. Hazard. Mater 149: 445–451.
Von Gunten, U. 2003. “Ozonation of Drinking Water: Part II. Disinfection and By-product Formation in Presence of Bromide, Iodide or Chlorine.” Water. Res. 37: 1469–1487.
Warne, M.A., D. Osborn, J.C. Lindon, and J.K. Nicholson. 1999. “Quantitative Structure-Toxicity Relationships for Halogenated Substituted-Benzenes to Vibrofisheri, Using Atom-Based SemiEmpirical Molecular-Orbital Descriptors.” Chemosphere 38(14): 3357–3382.
Wert, E.C., and F.L. Rosario-Ortiz. 2011. “Effect of Ozonation on Trihalomathane and Haloactic Acid Formation and Speciation in a Full- Scale Distribution System.” Ozone: Sci. Eng. 33(1): 14–22.
Yan, M., G.V. Korshin, and H.-S. Chang. 2014. “Examination of Disinfection By-products (DBP) Formation in Sources Waters: A Study Using Log- Transformed Differential Spectra.” Water Res. 50: 179–188.
Zhang, J., J. Yu, An W., Y. Wang, Y. Chen, J. Tai, and M. Yang. 2011. “Characterization of Disinfection Byproduct Formation Potential in 13 Source Waters in China.” J. Environ. Chem. 23(2): 183–188.
Zhang, X., and R.A. Minear. 2002. “Decomposition of Trihaloacetic Acid and the Formation of Corresponding Trihalomethanes in Drinking Water.” Water Res. 36: 3665–3673.































